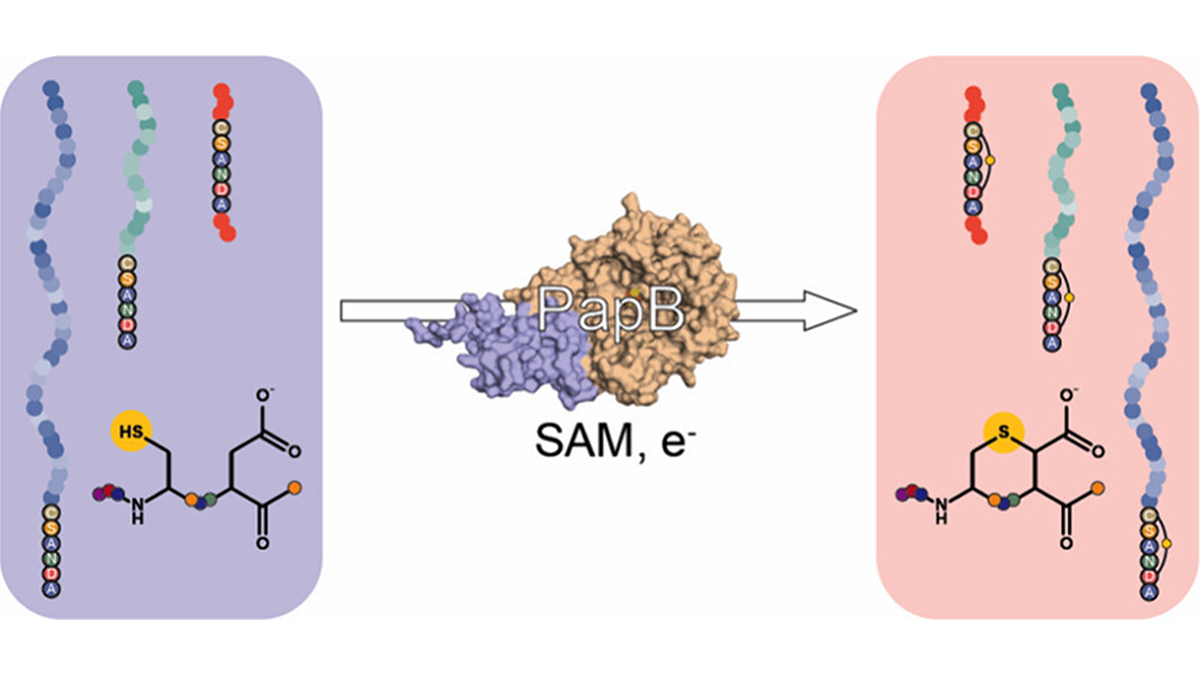
ユタ大学の化学研究者たちは、治療用ペプチドを緊密な環状構造に「結びつける」ことができる酵素、名付けてPapBを発見しました。このプロセスはマクロサイクル化として知られています。
この酵素の発見は、糖尿病や肥満の治療に使用されるGLP-1薬(セマグルチドなど)のより強力で長持ちするバージョンを開発するのに役立つかもしれないとのことです。
この研究は今週発表され、環状ペプチドの生成が重要である理由について詳述されています。環状構造は、薬剤をより安定させ、体内での持続時間を延ばし、生物学的標的に対する効果を向上させることができるからです。
共著者であり、ユタ大学の化学科の研究員でSethera TherapeuticsのCEO兼共同創設者であるカーステン・イーストマン氏は、「ペプチドは非常に反応性の高い化学的ハンドルを持つため、取り扱いが難しいことがあります。しかし、これが生物学においては非常に優れた特性をもたらします。体内で望ましい反応を引き起こすことができる一方で、特定の方法でそれらを修飾するのは難しいのです」と述べています。
彼はまた、「私たちの研究では、非常に制御された方法でペプチドを修飾または過剰修飾するための小さな分子機械である酵素の方法を示しており、これにより次世代のペプチド治療薬が実現できることを信じています」と付け加えました。
イーストマンとバンダリアン教授は、Sethera Therapeuticsを設立し、国立衛生研究所の資金を受けて大学での発見を商業化しています。彼らの取り組みは、ユタ大学の技術ライセンスオフィスから「2025年の創業者賞」に選ばれることで評価されました。この賞は、彼らのPolyMacrocyclic Peptide(pMCP)発見プラットフォームの開発に対して贈られました。
伝統的な化学的手法によるペプチドリングの閉鎖は、費用がかかり、薬の開発の後半で完遂するのが難しいことがあります。しかし、新たに発見された酵素は、標的を認識するために通常必要な「リーダー」配列なしに、ペプチド鎖を閉じるための正確な化学結合を自然に形成する、より簡潔でクリーンな代替手段を提供します。
最近の研究では、PapBという「ラジカルSAM」(S-アデノシル-L-メチオニン)酵素を使用して、GLP-1様ペプチドの端を硫黄-炭素結合(チオエテル)を介して接続したことが報告されています。
実験室でのテストにより、これらの環が形成されたことが確認されました。しかも、ペプチドには多くの現代のインクリン薬で見られる非標準的な構成要素が含まれていました。
リード著者であり、バンダリアン研究室の大学院生であるジェイク・ペディゴ氏は、「この酵素が非常に柔軟であることに驚きました。通常のリーダー配列なしでも機能し、さらに異常なアミノ酸を入れ替えても動作するのです。その精度と適応性の組み合わせが、PapBをペプチド工学における実用的なツールにしています」と述べています。
彼らの研究チームは、これまでに発表された研究でペプチドを結ぶ手法を示してきました。今回の最新の成果は、この手法が非常に有用であることを証明する証拠となっています。
研究者たちは、PapBを三つのGLP-1様ペプチドに適用した結果、いずれの場合でも酵素が開いたペプチドを環状バージョンに変換したことを報告しています。これにより、 PapBが薬の開発の後半でペプチドの再設計を行うためのプラグアンドプレイのバイオ触媒として機能できることが示唆されます。
イーストマン氏は、「この新しい研究は、以前の研究の重要な部分を新しい形で結び付けており、すでに市場に出回っている治療法に対して、これまで誰も達成できなかった特定の修飾を可能にしています。特に酵素的手法を使用することで」と述べています。
このチームの手法はペプチドの安定性を向上させ、治療効果を高める可能性があります。
人間の体はプロテアーゼという酵素によって、非常に効果的にタンパク質を再利用するため、ペプチドは個々のアミノ酸に分解されてしまいます。
イーストマン氏は、「優れた生物学的反応を持つペプチドがあっても、その反応が数分しか持続しなければ、有効な治療法にはなりません。私たちの酵素的手法を用いて端を結ぶことで、そのペプチドを体内でよく見られるプロテアーゼから隠すことになります。これにより、半減期を延ばすことができます」と説明しました。
リーダー配列が不要であることを実証することで、PapBが幅広いペプチドに対して使用可能であることが示され、新しい治療設計の可能性が広がります。
イーストマン氏は最後に、「大手製薬会社のGLP-1バックボーンはすでに優れています。私たちが追加するのは、これらの分子がさらに機能するようにするクリーンな後期の酵素的ステップです。小さく、明確に定義された環を構造に追加することで、薬の持続時間や安定性、さらにはシグナリングを調整することが可能になります」と述べています。
この研究は、2023年10月14日付で『ACS Bio & Med Chem Au』に掲載され、アメリカ化学会が発行しています。この研究は、国立一般医学科学研究所からの助成金によって支援されています。記事の内容は著者の責任であり、国立衛生研究所の公式な見解を必ずしも表しているわけではありません。
Sethera Therapeuticsについて
ユタ大学の化学者であるヴァヘ・バンダリアンとカーステン・イーストマンによって設立されたSethera Therapeuticsは、酵素的クロスリンク技術でペプチドベースの薬剤開発を革新しています。彼らのプラットフォームは、単一のターゲットまたは複数のターゲットに同時に結合することができる高い安定性を持つポリマクロサイクリックペプチドの合成を可能にし、治療設計において比類のない精度を提供します。この技術は、大学の研究で最初に開発され、NIHからの資金を得て、Sethera Therapeuticsに独占的にライセンスされました。
バナー画像は、ペプチドを結び付けるPapB酵素を示しています。
画像の出所:attheu